荧光定量PCR是实验室中出镜率非常高的一种检测方法。该方法通过在PCR体系中添加荧光基团来记录DNA产物的累积情况,从而达到对PCR过程进行实时监控的目的,并且可以通过数据分析计算出起始模板量,这就是“荧光定量”中“定量”一词的来源。
荧光定量PCR实验因为灵敏度高所以经常是差之毫厘谬以千里,所以在实验过程中,我们需要注意诸多细节,谨慎操作。小伙伴们看到这里就要着急了,我怎样才能做好qPCR实验,拿到实验结果,发表高分文章呢?
在荧光定量PCR实验中,难免会遇到一些奇怪的扩增曲线或熔解曲线,不管是开辟新课题新项目中的预实验探索还是持续验证中的反复测试,都有可能遇见。虽说异常曲线可能会千奇百怪,但仔细分析,了解清楚具体原因就有助于我们顺利完成实验,不用再投入更多时间精力重复实验。
扩增曲线异常
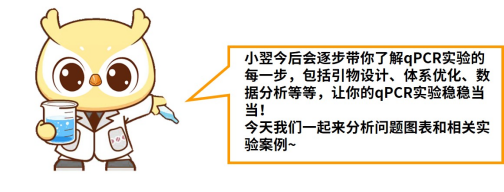
无扩增曲线出现
原因分析及解决方案:
荧光定量仪器参数设置错误,上机前对应荧光信号采集开关没有打开。可在问题数据的运行程序中检查,相关采集开关是否正常开启。若未正常开启,则需要重新准备上机反应体系,设置好对应的参数,打开采集开关再次检测。
仪器界面展示处以7500为例
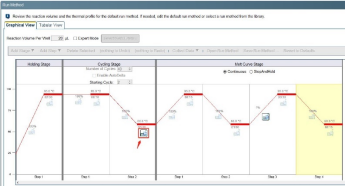
有光信号但无Ct值
原因分析及解决方案:
扩增曲线线性图显示为一条笔直的线或对数图的▲Rn不超过1且在低水平徘徊,则无扩增。
1)可能是引物降解带来的影响。当引物储存不当时会导致引物降解并失去特异性,进而降低扩增效率。可通过核酸电泳的方式检测引物的完整性,若原先的特异性条带变成弥散带,则表示引物发生降解。针对引物保存,需考虑以下四个建议:
- 引物冻干粉在长时间储存和储存温度上有着更强的灵活性和保障;
- 引物浓度对稳定性也会产生影响,不建议以低于10μM的浓度储存引物,在大多数情况下,100μM的引物使用更加灵活容易;
- 引物或探针也需和RNA一样分装储存,以尽可能减少反复冻融带来的影响;
- TE缓冲液的储存环境比水更加稳定。
2)可能是模板浓度太低造成检测困难。建议减少cDNA稀释浓度重复实验即可,通常情况下,未知浓度的样品先从原液开始测。
3)可能是模板降解。这种情况下,需要重新制备RNA模板或cDNA模板,重新实验。
扩增曲线对数图基线期异常
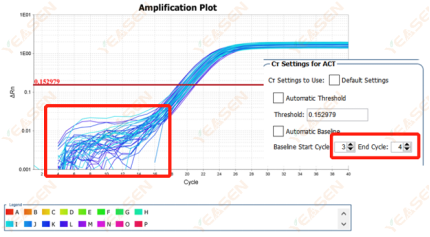
原因分析及解决方案:
在对数图扩增曲线中,若基线期为连续曲线,则有可能是基线期设置循环周期偏少造成。可以在设置中增大基线的终点值,调整后可恢复正常,如下图所示:

扩增曲线对数图曲线分段
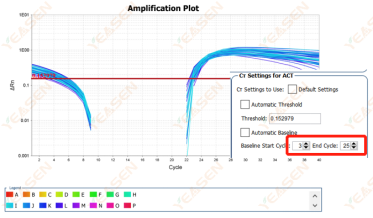
原因分析及解决方案:
在对数图扩增曲线中,若扩增曲线基线期连续且后续出现明显分段现象,则有可能是基线期设置循环周期偏多造成。可以在设置中减小基线的终点值,调整后可恢复正常,如下图所示:

扩增曲线线型图不平滑
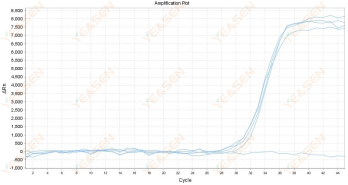
原因分析及解决方案:
1)PCR反应管可能没有盖紧,当仪器进行热循环时,反应液出现挥发、泄露。在上机前,建议用洁净的手套或镊子压紧管盖以避免该风险。
2)PCR反应液在管中可能出现挂壁,在反应进行时由于重力因素反应液下滑或最终进入反应体系。在上机前,建议使用桌面小离心机对PCR管进行离心,肉眼观察无反应液挂壁,上机过程小心为上,减少抖动和碰撞发生。
3)可能是体系中抑制物较多,导致荧光不稳定。当RNA提取样本充裕的情况下,建议重新提取高纯度RNA进行反转录、荧光定量。当RNA提取样本缺失或稀少的情况下,建议稀释cDNA后重新上机,减少抑制物的抑制作用。
4)可能是仪器开机后长时间运行,使用过度,导致荧光收集不稳定。建议让仪器待机/关机一段时间后,重新开启运行。
扩增曲线线性图无法到达平台期
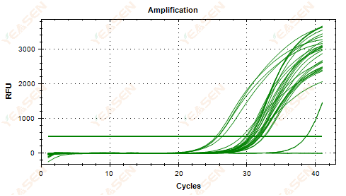
原因分析及解决方案:
1) 平台期对Ct值影响不大。计算Ct值时,是通过阈值线(上图绿色水平线)与扩增曲线指数期的交叉点进行的,故平台期对于Ct值的影响不大。
2) 无法到达平台期可能是因为循环数设置太少,增加循环数可有助于观察到明显的平台期。
3) 当试剂扩增效率比较低时,酶活力不持久,下降较快,平台期也可能会出现不明显的现象。可通过增加镁离子浓度或更换效力更强的酶解决该问题。
扩增曲线线性图平台期“低头”

原因分析及解决方案:
可能是基线选取的范围不正确,其中的基线终点大于曲线对应的Ct值。当模板DNA投入过多时(投入高浓度cDNA原液或cDNA上样比例>20%),基线范围仍取为3-15,其中会包含部分扩增信号,从而导致阈值线过高,对应的平台期在计算时会出现下滑现象。这种情况下,可减少基线期终点,重新分析数据。
扩增曲线Ct值偏大
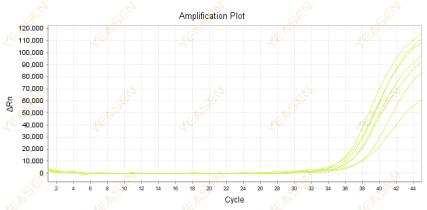
原因分析及解决方案:
1) 若目的基因在样品中的丰度较低,则可能出现Ct值偏大的现象。该情况下可选择增加反转录时RNA的投入量或者减少cDNA的稀释倍数可调整对应的Ct值。当RNA投入量是原先的2倍时,Ct值对应可减少1(21=2);当cDNA稀释倍数由8倍调整为2倍时,Ct值对应可减少2(22=4)。
2) 设计的目的片段过长,仅部分目的片段在每个循环中扩增,从而导致Ct值偏大。建议将目的扩增片段长度设计为80-200bp之内,不建议超过300bp。
3) 体系中可能存在抑制剂,导致扩增效率下降,最终使得Ct值偏大。建议减少投入的模板量或重新制备纯度更高的RNA。
扩增曲线重复性差
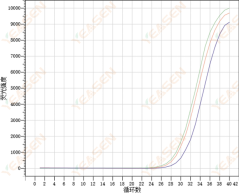
原因分析及解决方案:
1) 可能是加样误差大导致的重复性差。仪器方面,需要每年对移液枪进行一次校正。在操作方面,采取先加大体积后加小体积液体的方式。移液器使用时采取二档吸液一档出液的方式,若下一次移液不更换枪头,则第二枪开始一档吸液一档出液。
2) 试剂或预混体系没有彻底混匀,也会导致重复性偏差。建议在分装反应液前,先将反应液以震荡或吹打的形式进行充分混匀。上机之前,将PCR管离心,使得所有的液体都在反应管底部。
3) 仪器未使用ROX校正,则也可能发生重复性偏差的现象。最好选用ROX校正。当所用试剂不含ROX时或ROX添加浓度不合适时,将ROX校正关闭。
4)当基因本身丰度低或模板浓度低时,Ct值会在30以上,同时Ct值重复性差。该情况下,建议将复孔数增加至4-6个,从中适当舍弃1-2个偏差较大的数据。
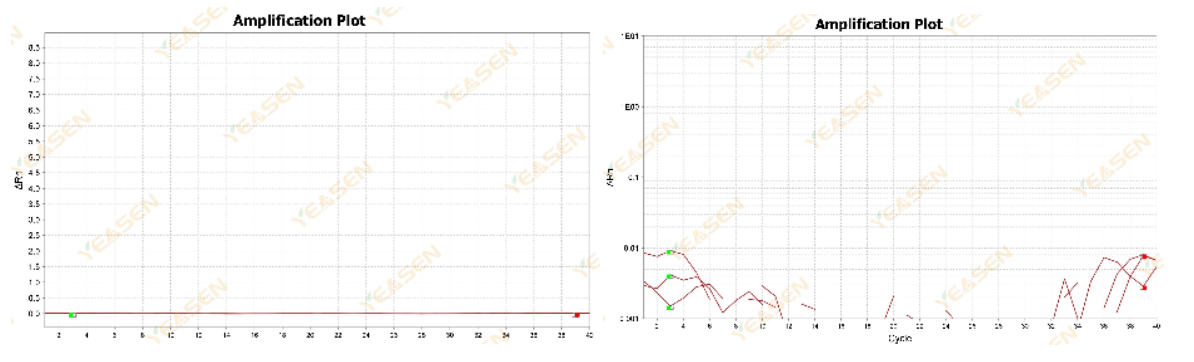
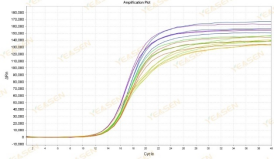
扩增曲线杂乱无规律

原因分析及解决方案:
可能是ROX浓度与机型不能匹配造成这种现象。建议在设置中找到Passive Reference后将ROX改为None,重新分析即可获取正常的扩增曲线,如下图所示。
熔解曲线异常
熔解曲线单峰但不尖锐
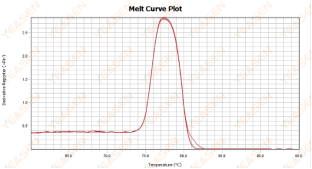
原因分析及解决方案:
可能存在大小相近的非特异扩增,可以通过两种方法进行判断,简单的方式是观察起峰到落峰的温度跨度,若跨度不大于7℃,则可视为单峰。另外相对复杂的方法是将产物进行高浓度琼脂糖电泳(如3%琼脂糖)进行辅助判断。
熔解曲线为双峰且较低峰Tm在80℃之前
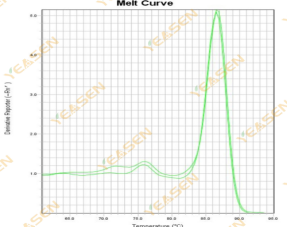
原因分析及解决方案:
引物二聚体在引物对之间存在部分序列同源性时会形成,其长度通常会低于80bp,在70℃范围区间会形成低荧光且更宽的波峰。具体的波峰大小会根据引物二聚体的大小和GC含量而发生变化。进行荧光定量之前,检查引物二聚体的方法有多种,最好的可视化方法是进行核酸电泳,形成的引物二聚体通常会在凝胶底部附近显示为弥散带。减少引物二聚体的方法如下:
- 优化热循环条件,主要是提高退火温度;
- 降低引物浓度。在多数情况下,引物终浓度为200 nM,可选择降低至60 nM;
- 第一次针对一个靶标设计引物时,可尝试设计三对引物组,选用其中效率最高、特异性表现最好的引物进行实验。
熔解曲线为双峰且较低峰Tm在80℃之后
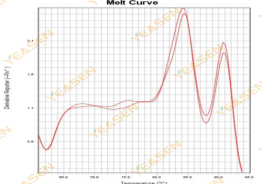
原因分析及解决方案:
1)可能是cDNA样本中存在gDNA污染,引物设计时未跨内含子造成的其他扩增产物。建议设计引物时跨内含子且不在单一外显子模块中设计,或在RNA提取时,选用带gDNA去除的RNA提取试剂盒,或是在反转录获取cDNA时,选用带gDNA去除的反转录试剂。
2)可能是引物特异性过差导致的非特异扩增。建议将引物序列输入至NCBI中进行特异性分析,检测在同物种中是否存在其他配对序列。
阴性对照(NTC)起峰且有熔解曲线峰
NTC:又称为无模板对照,指除DNA或cDNA样品以外的所有反应组分。在这些对照中检测到的扩增通常是由于引物二聚体或扩增的PCR产物污染造成。这两类污染会导致相关靶标的表达水平被人为的升高。
Ct>35,熔解曲线Tm值<80℃
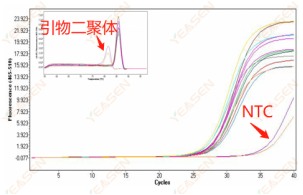
原因分析及解决方案:
引物二聚体导致的非特异扩增,具体解决方案可见上述【熔解曲线为双峰且较低峰Tm在80℃之前】。其中值得注意的点是,若实验组和阴性对照组之间的Ct值差值远大于10,则表示引物二聚体对于靶标片段扩增的影响不大,数据可用于分析。
Ct值<35,NTC熔解曲线与基因熔解曲线峰形重叠。
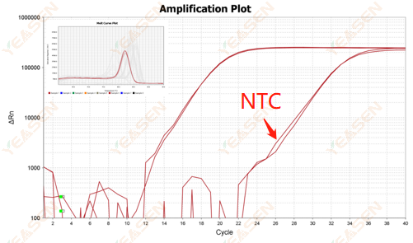
原因分析及解决方案:
这种情况下,多是由于体系中出现污染,例如水中、引物中、试剂中出现对应的模板,多为枪头未更换带来的交叉污染。该情况下,需要以控制变量的方式逐步排查污染源。
熔解曲线峰型杂乱
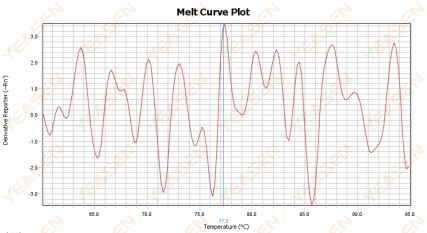
原因分析及解决方案:
1) 可能是反应体系中出现污染,建议结合阴性对照结果确认污染情况,从水、引物、酶和环境等注意排除污染。
2) 可能是荧光定量试剂暴露在强光或者高温下导致试剂失效进而导致该问题出现,建议用新的荧光定量试剂进行对比试验。
3) 耗材与仪器不匹配,不能满足荧光定量仪器光源对于耗材的需求。这种情况下,需确认仪器所对应的耗材要求,选择正确且质量有保证的耗材进行重复试验。
4)仪器长时间未校正也可能会引发该情况。仪器方面建议每一年校正,以保证数据的稳定性。
熔解曲线前端起杂峰
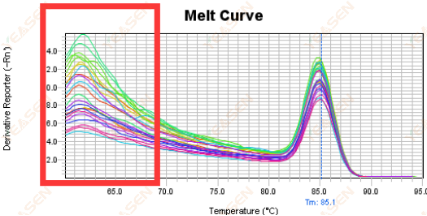
原因分析及解决方案:
可能是ROX浓度与机型不能匹配造成这种现象。建议在设置中找到Passive Reference后将ROX改为None,重新分析即可获取正常的熔解曲线,如下图所示。
以上是对荧光定量PCR中问题图表分析及实验案例的介绍,相信小伙伴们通过小翌的介绍,对如何分析问题图表已经有一定的了解啦。关于如何做好qPCR实验,小翌会陆续在公众号里传授秘籍哒,敬请期待哦。

